

图/文:田雨
传统光动力疗法(PDT)通过氧依赖途径产生活性氧(ROS),但其临床疗效在乏氧肿瘤微环境中受到显著制约。近年来,发展生物友好型非氧自由基介导的疾病治疗策略展现出潜在的价值。在众多非氧自由基中,氢自由基(H•)具有独特的强还原性与促氧化能力特性,已在抗肿瘤领域开展广泛研究(J. Am. Chem. Soc.,2021,143,868 &Angew. Chem. Int. Ed.,2023,135,e202214991)。然而,当前基于新型作用机制的H•发生器的发展及其应用探索仍较为有限。此外,肿瘤组织的乏氧异质性属性导致乏氧敏感前药(HAPs)时空特异性激活受限,制约了其临床转化潜力。基于此,本研究通过分子设计调控酚类光敏剂的激发态特性,不仅探索了H•产生新机制和实现了H•的高效光控释放,而且建立了基于H•介导的HAPs胞内激活新范式。以H•作为工具为发展肿瘤微环境适配性治疗提供新策略和为构建新型精准化疗协同增效治疗体系提供新方法。
研究团队设计并合成了以苯酚为核心的π-共轭光敏剂BTP-1。理论计算表明,BTP-1在三线激发态(T₁)的O–H键解离能(BDE)从基态(S₀)的80.5 kcal mol⁻¹大幅降至28.1 kcal mol⁻¹,使其在可见光(405 nm)下即可高效裂解产生活性H•。高分辨质谱及电子顺磁共振等表征手段证实了H•的生成及其释放机理。通过谷胱甘肽(GSH)的协同作用,系统实现了生理条件下的持续H•供给,突破了传统酚类化合物释放H•需高强度紫外线或高温诱导H•释放的局限。研究以临床HAPs代表药物TH-302为模型,证实H•可靶向还原其硝基咪唑基团,释放活性化疗药物Br-IPM。在6% O₂(中度乏氧)条件下,光活化系统仅需18分钟即可完成80%以上的TH-302转化,显著优于模拟的硝基还原酶催化路径。
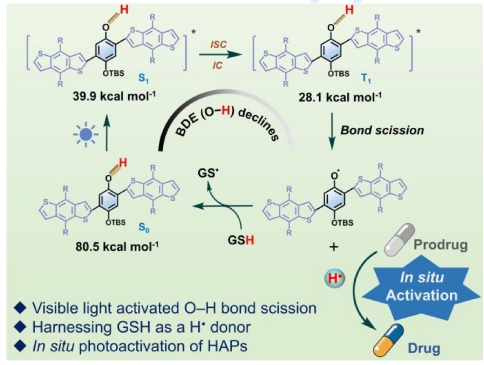
该研究首次通过光敏剂激发态BDE调控实现H•的可控生成,解决了肿瘤乏氧异质性导致的HAPs激活效率低的难题。其“H•化学还原+ H•诱导的生物还原”双机制为精准癌症治疗提供了新范式,兼容双光子激发的特性更适用于临床转化。
论文第一作者为南华大学药学院孙剑副教授,共同第一作者为彭金磊博士(目前任职南京中医药大学),通讯作者为南京大学冯福德教授、汪蓉教授和中国科学院化学研究所王树研究员。详见:Sun J, Peng J, Zhou J,Zhang X, Zhu C, Wang R, Feng F, Wang S. Hydrogen radical-based prodrug photoactivation by modulating bond dissociation energy of a phenolic photosensitizer.Sci. China Chem., 2025. DOI: 10.1007/s11426-025-2604-6.
孙剑,博士,南华大学副教授,硕士研究生导师。2018年博士毕业于南京大学,随后在南京大学(助理研究员)和中国科学院化学研究所(博士后)继续从事科学研究工作。2023年入职南华大学药学院。主要从事新型光控智能药物的开发及其在恶性肿瘤、心血管等疾病“诊疗一体化”研究。近年来承担国家自然科学基金项目、中国博士后面上项目、中科院特别研究助理项目、湖南省湖湘青年英才(荷尖)项目、北京分子科学国家研究中心项目等科研任务,共发表SCI论文40余篇(H指数17),其中包括以第一作者在Sci. China Chem.,J. Am. Chem. Soc.(高被引), Angew. Chem. Int. Ed.(两篇,都入选Very Important Paper论文)等国际著名期刊上发表论文9篇。
地址:中国 湖南衡阳 常胜西路28号 联系方式:0734-8282914 邮编:421001 版权所有:南华大学药学院