

图/文:何隆薇课题组
荧光成像技术由于其高灵敏度、高选择性、高时空分辨率、非侵入性、实时原位检测等优势,在基础研究和临床诊断领域已成为一种重要的新兴检测手段。开发高性能的光学诊断试剂是实现高保真、精准检测的前提和保障,在疾病的发生发展机制、早期诊断,以及药物开发和筛选等研究领域发挥重要作用。近日,南华大学药学院何隆薇教授团队在糖尿病肺病、糖尿病肾病、病理性衰老等疾病的荧光诊断试剂开发及相关病理机制探索和药物筛选应用方面取得系列研究成果。
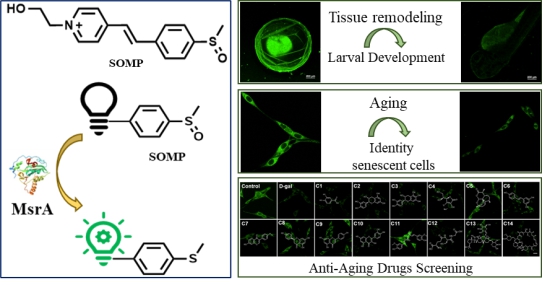
细胞增殖与衰老是密切相关的生物学过程,在组织重塑、应激反应及衰老相关疾病中扮演着双重角色。然而,细胞衰老的动态复杂性使得传统检测方法难以实现活细胞内生物标志物的原位精准监测,导致关键生物学信息丢失。研究表明,MsrA活性降低会缩短秀丽隐杆线虫、果蝇、小鼠等多种模式生物的寿命,而提高其表达水平则可延缓衰老并促进健康寿命。因此,MsrA被视为调控细胞衰老的关键分子靶点。为此,研究团队设计了由苯乙烯基吡啶鎓染料和亚砜基团构成的特异性MsrA荧光探针SOMP。该探针具有超高灵敏度(检测限达8.9 ng/mL)、优异的选择性(受MsrB2/B3干扰极小)和低细胞毒性的优势,适用于细胞长期观测。基于SOMP的卓越性能,该研究实现了多项创新应用:1)原位监测细胞增殖与幼体发育:首次在活细胞及模式生物中动态可视化MsrA活性变化。2)精准评估衰老进程:在多种衰老模型中成功追踪MsrA的活性变化,为衰老机制研究提供新方法。3)高通量抗衰老药物筛选:利用SOMP首次发现姜黄素的抗衰老作用可能与MsrA介导的氧化还原信号相关,为天然抗衰老药物开发提供新线索。该研究开发的SOMP探针突破了传统检测技术的局限,为细胞衰老的原位分析、衰老相关疾病机制探索及抗衰老药物开发提供了高效、可靠的新工具,有望为精准医学与衰老相关领域提供无创原位可视化新方法。该成果以“A Novel Visual Perspective for Tracking of Larval Development, Aging and Anti-Aging Drugs Screening by Fluorescent Sensing MsrA”为题发表于国际权威期刊《Analytical Chemistry》(中科院一区TOP期刊,影响因子6.8);该研究由团队博士研究生曾佳玉、药学院硕士研究生杨婷作为共同第一作者完成,南华大学附属第一医院周佳主任、附属南华医院程丹研究员和药学院何隆薇教授为通讯作者。
论文一链接:https://doi.org/10.1021/acs.analchem.4c07050
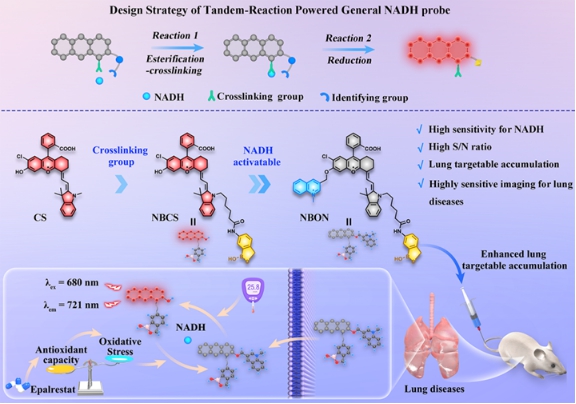
糖尿病作为一种全球高发的临床代谢性疾病,其长期高血糖状态可引发多器官并发症,但肺部作为糖尿病靶器官的病理机制(如NADH/NAD⁺失衡诱导氧化应激)长期缺乏实时监测工具。传统NADH探针因灵敏度低(检测限μM级)、组织穿透性差(可见光成像)及非特异性干扰等问题,难以实现活体深部组织(如肺部)的精准检测。为此,本研究提出一种基于串联反应策略的近红外(NIR)荧光试剂NBON,通过结合苯硼酸靶向基团(邻近二醇酯化交联)与半菁染料荧光基团(NIR发射波长721 nm),实现了NADH的高灵敏度检测(检测限45 nM)及肺部特异性富集。在细胞层面,NBON成功揭示了高糖环境下NADH的动态波动及依帕司他(EPS)通过抑制醛糖还原酶恢复氧化还原平衡的机制;在动物模型中,该探针实时成像链脲佐菌素(STZ)诱导的糖尿病小鼠肺部NADH异常累积,并评估了二甲双胍/EPS的治疗效果;此外,NBON还可区分肺转移瘤与原位肿瘤组织,辅助术中精准切除。这一研究不仅填补了NADH活体动态监测的技术空白,首次在分子层面阐明EPS缓解糖尿病肺病的抗氧化机制,更为糖尿病并发症诊疗、药物开发及肿瘤精准手术提供了通用化工具,推动了代谢性疾病研究与临床转化的深度融合。该成果以“Tandem reaction-powered near-infrared fluorescent molecular reporter for real-time imaging of lung diseases”为题发表在国际权威期刊《Chemical Science》(中科院1区TOP期刊,影响因子7.6);南华大学药学院和附属南华医院为本论文通讯单位,团队成员硕士生胡琰、助理研究员张红帅博士和硕士生丁一腾为论文的共同第一作者,南华大学附属南华医院程丹研究员和药学院何隆薇教授为论文的共同通讯作者。
论文二链接:https://doi.org/10.1039/D5SC01488C
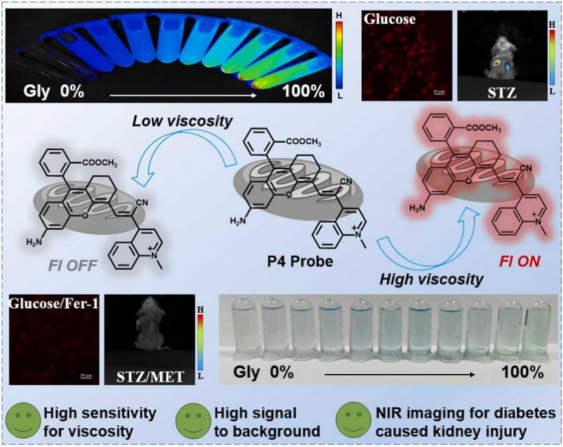
糖尿病肾损伤已成为导致肾脏疾病的重要原因之一。早期发现和干预可以有效延缓肾脏疾病的发展。粘度作为细胞微环境的关键参数,在维持线粒体功能和细胞稳态中起着关键作用,其失调与糖尿病肾损伤的发病机制密切相关。然而,很少有报道使用荧光探针来确定糖尿病肾损伤过程中的线粒体粘度变化。在此,该团队使用“渐进优化”策略开发了一种基于半花菁的近红外荧光探针P4,能够对肾细胞和体内线粒体粘度变化进行靶向成像。P4探针对粘度具有高灵敏度和选择性,在具有高线性关系的高粘度环境中表现出约146倍的信号增强。P4的荧光量子产率从PBS(低粘度)中的< 0.001增加到90%甘油(高粘度)中的0.12。此外,P4探针显示出优异的线粒体定位效率,能够在糖尿病肾损伤进展和治疗干预期间实时监测线粒体粘度变化。P4探针在糖尿病肾损伤小鼠模型中检测到肾脏粘度变化,与健康组照相比,信号强度增加了1.5倍。使用P4探针,首次在高葡萄糖诱导的肾细胞损伤模型中观察到粘度变化与铁死亡相关。这项工作将为更深入地了解肾脏疾病的粘度变化提供有意义的工具,并有望促进肾脏疾病的早期诊断和治疗。相关研究成果以“Fabricating a mitochondrial viscosity-activated fluorescent probe for highly sensitive imaging of kidney injury in vivo”为题发表在国际权威期刊《Sensors and Actuators B: Chemical》(中科院一区TOP期刊,影响因子8.0);本项工作由团队硕士生郑显贵和助理研究员张红帅博士为共同第一作者完成,南华大学附属南华医院程丹研究员和药学院何隆薇教授为本文通讯作者。
地址:中国 湖南衡阳 常胜西路28号 联系方式:0734-8282914 邮编:421001 版权所有:南华大学药学院