

图/文:王震课题组
代谢重编程是恶性肿瘤的标志性特征之一。烟酰胺腺嘌呤二核苷酸(NAD⁺)在肿瘤代谢重编程中发挥关键作用,作为能量代谢(如糖酵解、TCA循环、氧化磷酸化)和DNA修复、表观遗传调控等多条生存通路的核心辅酶,其持续供应支撑着肿瘤细胞的快速增殖与存活。在多种肿瘤细胞中,NAD+的生物合成主要依赖以烟酰胺(NAM)或烟酰胺核糖为起始物的挽救合成途径。烟酰胺磷酸核糖转移酶(NAMPT)是NAD+挽救合成途径中的关键限速酶,且在胃癌细胞中高表达,抑制NAMPT及阻断NAD+生物合成或可成为胃癌治疗的有效策略。
江伟凡博士所在王震教授团队,前期以HDAC ClassI类选择性抑制剂恩替诺特和西达本胺为先导,基于非经典生物电子等排原理反转酰胺键,开发得到了具有较好血脑屏障透过率及抗胶质瘤活性的哌嗪取代苯甲酰胺类衍生物L19(Eur. J. Med. Chem., 2022, 227: 113908),以及具有抗未分化胃癌细胞活性的邻氨基苯甲酰胺类衍生物F8(Eur. J. Med. Chem., 2022, 227: 113888),其在实验动物体内的抗人未分化胃癌细胞HGC-27移植瘤活性,显著优于一线化疗药物卡培他滨和三线小分子靶向药物阿帕替尼。同时针对F8溶解性差、体内吸收差和给药剂量较大等问题,团队前期通过F8成盐提高其成药性,改善其体内药代动力学性质和抗移植瘤活性(Front. Pharmacol., 2023, 11: 1118397)。虽然研究显示,F8及其盐酸盐可作为一种有前景抗未分化胃癌药物,但其抗胃癌作用靶点及机制仍不清楚。
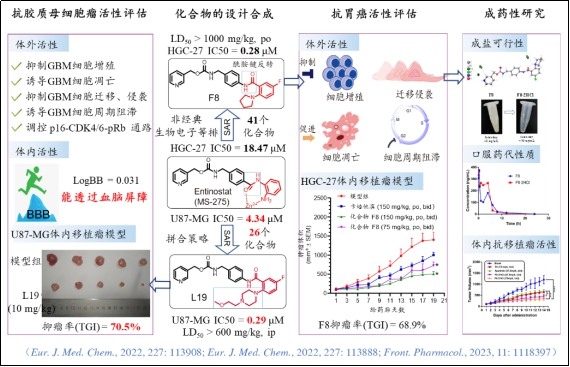
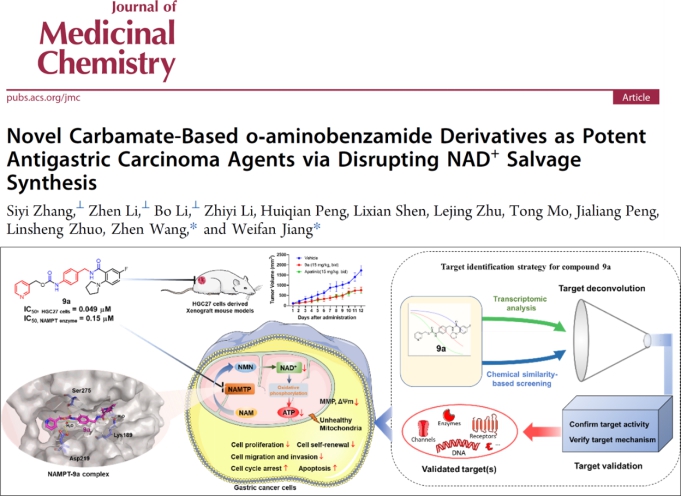
基于此基础,本研究以F8骨架结构为先导,通过对其进一步修饰改造及抗胃癌细胞活性筛选得到了化合物9a。相比前体化合物F8,9a具有更强的抗未分化胃癌细胞活性(HGC-27 cells, IC50= 0.049 μM)。其抗胃癌作用涉及克隆形成、细胞增殖、转移、细胞周期和代谢等多个细胞过程。转录组分析与基于配体的靶点预测方法表明,9a是一种潜在的NAMPT抑制剂(IC₅₀ = 0.15 μM),能够通过降低细胞内NAD⁺和ATP水平,从而发挥抗胃癌作用。该研究表明9a是一种具有显著抗未分化型胃癌作用的潜在NAMPT抑制剂,为通过靶向NAD⁺生物合成开发新型抗胃癌药物奠定了基础。研究结果发表于药物化学经典权威期刊《Journalof Medicinal Chemistry》(中科院1区Top,DOl: 10.1021/acs.jmedchem.4c02686)。本论文通讯作者为南华大学药学院王震教授和江伟凡博士,第一作者为南华大学药学院硕士研究生张思怡、李真及李博。
药物设计与研发实验室课题组简介:
南华大学王震教授课题组主要研究方向为“天然产物导向的合成化学、药物化学和化学生物学”,即以厚植独特理论基础的中医药作为原创性新化学实体发现的丰富资源和科学依据,紧扣“新药先导化合物的开发和优化”,围绕神经退行性疾病、肿瘤、病原微生物感染等重大疾病进行新药创制研究。课题组自2015年成立以来,承担了国家海外高层次人才引进计划青年项目、国家自然科学基金、中国博士后科学基金、湖南省自然科学基金等多项科研项目,已在J. Am. Chem. Soc., Angew. Chem. Int. Ed., J. Med. Chem., Eur. J. Med. Chem.等国际一流期刊上发表了科研论文120余篇;申请专利30余项(授权17项,转让1项)。实验室已有二十名毕业生前往北京大学、东京大学、美国布朗大学和Sharpless研究所等著名院校机构深造。
地址:中国 湖南衡阳 常胜西路28号 联系方式:0734-8282914 邮编:421001 版权所有:南华大学药学院